
Разбор заданий: ответы к Олимпиаде ВСОШ по Химии 10 класс, муниципальный этап для Республики Дагестан на 22.11.2025 г. Включает в себя авторский разбор вопросов для 10 класса. Материалы являются официальными взяты и опубликованы в ознакомительных целях
Муниципальный этап ВСОШ по Химии 10 класс
Ответы к заданиям на 22.11.2025
Задание 1. Серия неорганических превращений Юный химик Вася Колбочкин, попав в химическую лабораторию, решил провести небольшой эксперимент с одним из малоактивных металлов — медью. Вася взял небольшой кусочек этого металла и поместил его в разбавленную азотную кислоту. После окончания выделения бесцветного газа с относительной плотностью по водороду, равной 15, он получил синий раствор соли A (реакция 1). Добавив к нему водный раствор аммиака, он наблюдал выпадение синего осадка оксида B (реакция 2) и его последующее растворение с образованием сине-фиолетового раствора комплексного соединения C (реакция 3). Добавив к полученному раствору сульфид натрия, он получил чёрный осадок бинарного соединения D (реакция 4), при растворении которого в концентрированной азотной кислоте образовался раствор соли A и серной кислоты (реакция 5). При добавлении к этому раствору недостатка иодида калия выпал белый кристаллический осадок E и тёмный осадок простого вещества F, не содержащего медь (реакция 6). Дополнительно известно, что во всех соединениях, кроме E, медь находится в степени окисления +2, F не содержит меди. В комплексном соединении C присутствует комплексный катион, содержащий две молекулы воды и четыре молекулы аммиака.
1. Определите формулы веществ A–F.
2. Напишите уравнения реакций 1–6.
3. В какой цвет окрасится разбавленная серная кислота при помещении в неё кусочка меди?
→ Раскрыть ответ
Задание 2. Для веществ ионного строения, которые плохо растворяются в воде, обычно в справочных таблицах приводятся значения произведения растворимости Ks. Однако юный химик Вася, взявший в библиотеке справочник начала X века, обнаружил, что в нём для хлорида свинца(II) указана массовая растворимость при двух разных температурах
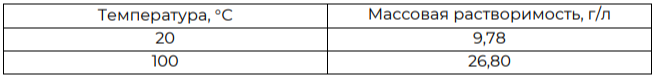
Заинтересовавшись этим, Вася решил привести данные из старого справочника к современному виду, а заодно и оценить тепловой эффект реакции растворения PbCl2 в воде. Забыв, что он ещё совсем юный и испытывает сложности с расчётами, он решил обратиться к вам за помощью.
Рассчитайте молярные растворимости (в моль/л) вещества при температурах 20С и 100С.
2. Рассчитайте равновесные концентрации катионов [Pb2+] и [Cl- ] в каждом из приготовленных растворов.
3. Рассчитайте произведение растворимости PbCl2 при 20С и 100С. 4. Оцените тепловой эффект реакции растворения PbCl2 в воде (>0 или <0). Ответ аргументируйте. Произведение растворимости хлорида свинца может быть вычислено как константа равновесия соответствующей реакции растворения:
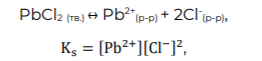
где [Pb2+] и [Cl- ] — равновесные концентрации ионов в насыщенном растворе (в моль/л), где содержание вещества равно его растворимости.
→ Раскрыть ответ
Задание 3. Для проведения экспериментов юный химик Вася взял два раствора медного купороса CuSO4∙5H2O, приготовленных из 10,00 г и 15,00 г кристаллогидрата и 100,0 мл воды, и смешал их в массовом соотношении 2:1. 1. Рассчитайте массовую долю сульфата меди CuSO4 в каждом из изначальных растворов и в конечном растворе, полученном при их смешении. К полученному на предыдущем этапе раствору массой 250,0 г добавили 100,0 г 10,00 %-ного раствора гидроксида натрия. 2. Вычислите массовые доли всех растворённых веществ в полученном растворе.
→ Раскрыть ответ