
Официальные задания и ответы Сириус для 7-8, 9, 10, 11 класса школьного этапа 2024/25 всероссийской олимпиады школьников ВсОШ по Химии 3-ей группы 14.10.2024 на официальном сайте Сириуса uts.sirius.online.
Ответы школьного этапа по Химии 14.10.2024
Задания 7-8 класс
1. Установите соответствие между названием вещества, его составом и строением.
Иод
Уксусная кислота
Пищевая сода
Графит
Спирт
Простое вещество молекулярного строения
Сложное вещество немолекулярного строения, состоящее из ионов
Сложное вещество молекулярного строения
Простое вещество немолекулярного строения
→ Узнать ответ
2. Человеческий организм состоит из более чем 60 химических элементов, из которых примерно половина относится к жизненно необходимым. Для среднестатистического организма провели анализ и установили количества атомов важнейших элементов. Результат приведён в таблице в пересчёте на 1000 атомов. Установите соответствие между названием элемента и количеством его атомов.
Элемент Количество атомов из 1000
Водород
Кислород
Кальций
Азот
2
11
240
→ Узнать ответ
3. Неизвестное вещество жидкость, водный раствор которой используется в быту. Её элементный состав, выраженный в процентах, описывается круговой диаграммой.
Какое это вещество?
(CuOH)2CO3
H2O2
Br2
NaCl
C2H4O2
HNO3
Какие это проценты атомные или массовые?
Атомные
Массовые
→ Узнать ответ
4. В Периодической системе химических элементов, издаваемой в нашей стране в 1980‑е годы, элемент с порядковым номером 104 был назван курчатовием в честь советского физика‑ядерщика И.В. Курчатова.

Запишите современный символ этого элемента, утверждённый ИЮПАК.
В каком периоде находится этот элемент?
→ Узнать ответ
5. Для эксперимента выбрана смесь двух веществ X и Y, которая может быть разделена как методом отстаивания при добавлении смеси к воде, так и при помощи магнита.
Определите вещество X
Золото
Медь
Древесный уголь
Кварцевый песок
Мрамор
Поваренная соль
Сахарный песок
Железо
Определите вещество Y
Железо
Медь
Золото
Поваренная соль
Кварцевый песок
Древесный уголь
Мрамор
Сахарный песок
Что происходит при нагревании этой смеси в кислороде?
Горение с образованием светящихся искр, выделение газа
Только выделение газа
Взрыв
Изменений не наблюдается
→ Узнать ответ
6. При сжигании смеси угля с серой на воздухе образовалась газовая смесь, в которой на одну молекулу сернистого газа SO2 приходится четыре молекулы углекислого газа CO2
Определите массовую долю серы в исходной смеси. Ответ выразите в процентах, округлите до целых.
Дым представляет собой мельчайшие твёрдые частицы, взвешенные в воздухе. Выберите смеси веществ, при горении которых в избытке кислорода НЕ образуется дым:
CH4 + H2S
H2 + O2
P + C
Mg + S
→ Узнать ответ
7. Атмосфера есть не только у Земли, но и у большинства крупных тел в Солнечной системе. У одного из спутников Юпитера атмосфера (очень тонкая) состоит только из газообразного простого вещества X. Этот газ образуется при разложении твёрдого вещества Y на поверхности спутника под действием солнечного ветра и космического излучения.

Известно, что вещества X и Y абсолютно необходимы для поддержания жизни на Земле. В земных лабораториях вещество X получают разложением некоторых солей.
Запишите формулу вещества X.
Заполните пропуски в уравнении разложения Y.
H2O
H2O2
O2
H2
8. Установите соответствие между схемой химической реакции (без коэффициентов) и моделями молекул вовлечённых в неё реагентов и продуктов. В представленных моделях «шариками» одного цвета показаны атомы одного и того же химического элемента, а молекулы взяты в стехиометрических соотношениях.
| Реагенты | Продукты | Схема реакции |
C2H4 + O2→CO2 + H2O CH4 + O2→CO2 + H2O CO + O2→CO2 CH4→C2H2 + H2 | ||
C2H4 + O2→CO2 + H2O CH4 + O2→CO2 + H2O CO + O2→CO2 CH4→C2H2 + H2 | ||
C2H4 + O2→CO2 + H2O CH4 + O2→CO2 + H2O CO + O2→CO2 CH4→C2H2 + H2 | ||
C2H4 + O2→CO2 + H2O CH4 + O2→CO2 + H2O CO + O2→CO2 CH4→C2H2 + H2 |
9. Один из самых красивых минералов меди состоит из четырёх элементов: число атомов меди составляет 1/5 от общего числа атомов, атомов углерода и водорода поровну, а атомов кислорода в 4 раза больше, чем водорода.

Определите простейшую формулу минерала. Cu C H O
Сколько граммов меди содержится в 100 г этого минерала? Ответ округлите до целых.
→ Узнать ответ
10. Для получения газа X собрали прибор, как показано на рисунке 1.
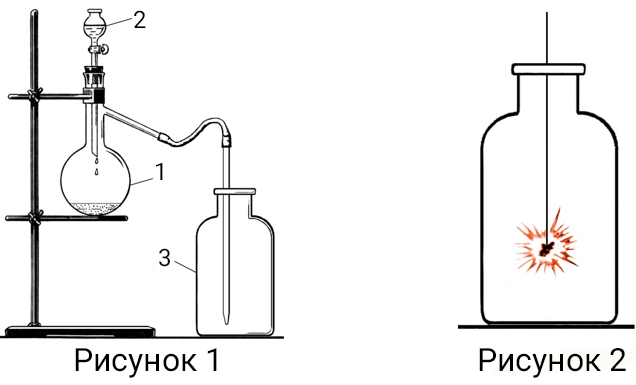
В колбу‑реактор (1) поместили небольшое количество порошка оксида марганца (IV). Из капельной воронки (2) колбу (1) добавляли раствор бинарного соединения А. В присутствии оксида марганца (IV) А разлагалось на два вещества: Б и В. Б одно из самых распространённых соединений на нашей планете. В простое газообразное вещество, входящее в состав земной атмосферы. Вещество В отводили по газоотводной трубке и собирали в банку (3). После того, как банка (3) была полностью заполнена газом В, в неё внесли тлеющий уголек (см. рисунок 2). Уголь раскалился и стал интенсивно гореть. При горении угля в газе В образуется газообразное вещество Г. При добавлении в банку с газом Г известковой воды наблюдали её помутнение за счёт образования осадка, вещества Д.Вещества А Д содержат в своём составе атомы одного и того же химического элемента X.
Запишите химический символ элемента X.
Ответ:
Установите состав веществ А — Д. В ответ запишите их формулы.
→ Узнать ответ
11. Химический элемент хром образует оксиды, в которых его валентность равна II, III, IV, VI.
Запишите химическую формулу оксида хрома X, в котором содержание кислорода по массе наиболее близко к 50 %.
При нагревании X происходит реакция разложения с выделением газа Y, в атмосфере которого загорается тлеющая лучинка. Вторым продуктом реакции является оксид хрома Z, в котором валентность хрома в 2 раза меньше, чем в оксиде X.
Запишите химические формулы веществ Y и Z.
Вещество Y
Вещество Z
→ Узнать ответ
12. Сасык это одно из самых крупных солёных озёр в Крыму.
Из воды этого озера добывается поваренная соль. Для этого в начале зимы солёную воду перекачивают в подготовительные бассейны. Вода из бассейнов постепенно испаряется, получается крепкий раствор соли «рапа». Выпадает осадок механических примесей, частичек ила, песка, кристаллизующихся солей (гипса, карбонатов кальция и железа). В конце весны рапу перекачивают из подготовительных бассейнов в садочные. Летом вода испаряется ещё быстрее, на дно оседает поваренная соль. В конце августа её начинают убирать.
Выберите названия методов разделения смесей, которые используются в описанном выше технологическом процессе:
Отстаивание
Фильтрование
Экстракция
Хроматография
Перегонка
Кристаллизация
Плотность рапы, перекачиваемой в садочные бассейны, составляет 1.08 г/см3. Массовая доля хлорида натрия в этом растворе —7.5 %. Определите теоретически возможную массу поваренной соли, которую можно получить из 1 м3 рапы. Ответ выразите в килограммах, округлите до целых.
→ Узнать ответ
Задания 9 класс
1. В организме человека железо содержится главным образом в составе гемоглобина белка крови. В этом белке железо входит в состав фрагмента, который называется гемом и имеет формулу C34H32O4N4Fe.

Молярная масса гемоглобина составляет около 64500 г/моль; в его составе 4 гема. Примите, что 1 л крови содержит 135 г гемоглобина, а взрослый человеческий организм содержит 4.8 л крови.
Определите массу железа в организме человека, считая, что оно находится только в форме гемоглобина. Ответ выразите в граммах, округлите до десятых.
Число 1 гем способен связать одну молекулу кислорода. Какой максимальный объём кислорода (н.у.) может быть связан гемоглобином, содержащимся в крови взрослого человека? Ответ выразите в миллилитрах, округлите до целых.
→ Узнать ответ
2. Чат‑бот с искусственным интеллектом написал оды двум разным химическим элементам:
Элемент 1 Ты тяжёлый, как грусть, но гибкий, как вода. В тебе мощь, что защищает и созидает, и тайна времени, что оставляет свой след на всех вещах, словно небесная печать. Ты душа старинных труб и пушек, что грохотали на полях сражений. В тебе тайна красок, что оживляют мир своими цветами. Ты пепел атомов, что несёт в себе бессмертие.
Элемент 2 Ты дитя огня, яркое, как солнце, но с запахом дыма, с душой вулкана и сердцем молнии! Ты источник жизни, но и смерти, ты бог двух ликов, что может как даровать, так и отнять. Ты душа пороха, что взрывается с оглушительным рёвом, но твоя сила в простом яйце! Ты в желтке, что питает зарождающуюся жизнь, и в белке, что защищает от внешнего мира.
Догадавшись, что это за элементы, запишите формулу продукта реакции образованных ими простых веществ между собой при нагревании.
→ Узнать ответ
3. Установите соответствие между твёрдыми веществами и растворами, взаимодействие между которыми (при комнатной температуре или умеренном нагревании) приведёт к выделению газа.Na2CO3 твёрдый
NH4Cl твёрдый
NaH твёрдый
NaI твёрдый
HCl (водный раствор)
H2SO4 (конц.)
KCl (водный раствор)
KOH (водный раствор)
→ Узнать ответ
4. Одним из самых распространённых на Земле классов веществ являются оксиды соединения элементов с кислородом. Установите соответствие между формулами оксидов и предметами, в которых содержатся эти оксиды.
Формулы
Предметы
SiO2
Al2O3
Fe2O3
PbO2
NO2
CO

5. Сколько нужно теплоты, чтобы нагреть воздух в бане размером 5×5 м и высотой 2 м от 25 до 65 ∘C, если пренебрегать потерями тепла и нагретого воздуха? Теплоёмкость воздуха 0.72 кДж/(кг⋅∘C), плотность при 25∘C 1.18 кг/м3. Ответ выразите в килоджоулях.
Теплота сгорания дров из берёзы и сосны равна 1900 и 1500 кВт⋅ч/м3 соответственно. 1 м3 берёзовых дров стоит 1800 рублей, а сосновых 1600 рублей. Какими дровами будет дешевле топить баню?
Берёзовыми
Сосновыми
Одинаково
Сколько рублей нужно потратить на сосновые дрова, чтобы 10 раз нагреть с их помощью воздух в бане размером 5×5 м и высотой 2 м от 25 до 65 ∘C? Потерями тепла и нагретого воздуха пренебрегите.
→ Узнать ответ
6. Два «гнома» элементы‑соседи по периодической системе. Их бывает сложно отделить друг от друга, в том числе при получении из природного сырья, где они часто встречаются вместе. Для них наиболее характерна одна и та же степень окисления, а их атомные массы различаются всего на 0.4 %. Запишите химический символ элемента с меньшей атомной массой.
→ Узнать ответ
7. В распоряжении школьника имелся водный раствор вещества X и водный раствор вещества Y Опустив в эти растворы универсальные индикаторные бумаги, мальчик обнаружил, что они окрасились в следующие цвета:
Добавление раствора X к раствору Y привело к интенсивному выделению газа тяжелее воздуха, не имеющего цвета и запаха; в растворе при этом осталось только бинарное соединение Z, кристаллизующееся в виде кристаллов кубической формы. Это вещество в количествах до нескольких килограммов можно найти почти в каждом домохозяйстве.
Запишите формулу вещества X.
Запишите формулу вещества Y.
Известно, что концентрация раствора X составляла 0.05 моль/л, а Y 0.1 М. Во сколько раз объём добавленного раствора X превышает объём раствора Y?
→ Узнать ответ
8. В пробирку с разбавленной серной кислотой добавили кусочек неизвестного металла. Наблюдали выделение газа без запаха и образование прозрачного бесцветного раствора. Выберите все верные утверждения об этом процессе:
В растворе образовался сульфат металла
Выделившийся газ SO2
Металл находится в ряду активности металлов правее водорода
Произошла реакция нейтрализации
Серная кислота является окислителем в реакции
Концентрация серной кислоты в растворе снизилась
Какой металл мог быть добавлен?
Магний
Кальций
Цинк
Никель
→ Узнать ответ
9. Растворённые в воде вещества снижают температуру её замерзания на величину ΔT, определяемую уравнением:
ΔT=i⋅K⋅cm, где i количество ионов, образующихся при диссоциации молекулы вещества (например, 2 для NaCl), K криоскопическая константа, равная 1.86 К⋅кг⋅моль−1 а cm моляльная концентрация растворённого вещества, выраженная в моль вещества на 1
1 кг растворителя.
Определите температуру замерзания водного раствора Ca(NO3)2, содержащего 10 г соли в 260 г раствора. Ответ выразите в градусах Цельсия, округлите до десятых.
→ Узнать ответ
10. Выберите на картинке предмет, используемый для хранения раствора фенолфталеина и его добавления к исследуемым растворам:
Выберите на картинке предмет, используемый для добавления порошкообразных веществ в колбу:
11. Каждый из анионов X и Y образован двумя элементами, заряд ядра которых отличается на единицу. Y может быть получен окислением X; при этом из 1.000 г калиевой соли аниона X образуется 1.188 г калиевой соли аниона Y.
Какая масса калиевой соли X необходима для получения 2.000 г калиевой соли Y? Ответ выразите в граммах, округлите до сотых.
Определите формулы X и Y. В ответ запишите формулу калиевой соли аниона Y.
→ Узнать ответ
12. Серосодержащие аналоги фосфорной кислоты с общей формулой H3PSnO4−n называются тиофосфорными кислотами, а их соли тиофосфатами. В зависимости от значения n
различают моно‑ (n=1), ди‑, три‑ и тетратиофосфаты.
Некоторый тиофосфат калия содержит 45.0% металла по массе. Определите значение n для этого образца.
Число
Средний дитиофосфат некоторого одновалентного металла содержит 11 молекул кристаллизационной воды. Массовая доля фосфора в нём составляет 5.32. Запишите химический символ металла, содержащегося в составе соли.
→ Узнать ответ
Задания 10 класс
1. Окислители X и Y одинакового качественного состава широко используются в промышленности. Так, X применяют в окислительной переработке сульфидных руд, производстве стали, серной и азотной кислоты; Y при отбеливании бумаги и очистке воды.
Запишите формулу X
Запишите формулу Y
Y обладает невысокой устойчивостью и со временем превращается в X
Сколько молей X можно получить при полном разложении 6 моль Y?
→ Узнать ответ
2. Чат‑бот с искусственным интеллектом написал оды двум разным химическим элементам:
Элемент 1
Ты был скрыт в бурых глыбах, как драгоценный камень, но человек раскрыл твою тайну, с помощью электричества и науки вызволил тебя из плена. Ты, лёгкий, как пух, но прочный, как сталь, вырвался из объятий земли, чтобы стать символом нового века! Ты, как волшебник, преобразил мир! Ты в крыльях самолетов, что парят над землёй, в кораблях, что бороздят океаны, в машинах, что мчатся по дорогам. Ты проводник мысли, что передаёт знания и идеи через пространство и время!
Элемент 2
Твой цвет цвет ночи, что скрывает тайны, твой запах запах моря, что плещет у берегов тайных островов, в твоём дыхании фиолетовый туман. Ты душа морской воды, что лечит раны и защищает от болезней. Ты великий алхимик, что превращает обычную соль в лекарство, что спасает жизни.
Простые вещества, образованные элементами 1 и 2, бурно реагируют между собой в присутствии небольших количеств воды. Запишите формулу продукта их реакции.
3. Студенты Кембриджского университета выносили из практикума по органической химии натрий и кидали его в бак с водой, предназначенной для наполнения бассейна ботанического сада, в котором содержатся кувшинки виктория Круса.
Когда растения начали погибать одно за другим, сотрудники сада отобрали пробы остатков воды из бака и провели их исследование, с ужасом обнаружив, что pH воды равен 12
Сколько граммов натрия было брошено студентами в бак, если объём воды в нём составляет 5000 литров? Ответ округлите до целых. Исходный pH считайте равным 7.0
Практикум посетили 12 групп студентов по 10 человек в каждой. На занятии каждому студенту выдали 1 моль натрия для синтеза. Обычно студенты используют половину натрия по назначению, а половину сбрасывают в бак, за исключением тех, кто состоит в партии «зелёных». Какая доля студентов состоит в партии «зелёных»? Ответ выразите в процентах, округлите до целых.
Ситуацию исправили, долив в баccейн 36%-ной соляной кислоты с плотностью 1.18 г/мл до нейтральной реакции среды. Какой объём кислоты понадобился для этого? Ответ выразите в литрах, округлите до десятых. Считайте, что вся вода из бака оказалась в бассейне.
→ Узнать ответ
4. Определите число изомерных соединений состава C4H8 (включая стереоизомеры), соответствующих каждому из условий.
При окислении подкисленным перманганатом калия образует углекислый газ
Реагирует с кислородом с образованием углекислого газа
Оптически активен
Содержит цикл
Все атомы углерода лежат в одной плоскости
1
2
3
4
5
6
7
8
9
10
→ Узнать ответ
5. 1.00 л газообразного соединения элемента X с углеродом весит на 15.4% меньше, чем тот же объём газообразного соединения элемента X с кремнием при одинаковых температуре и давлении.
Запишите химический символ элемента X
Определите массу 2.00 л газообразного соединения элемента X с кремнием при н.у. Ответ выразите в граммах, округлите до десятых
→ Узнать ответ
6. Если газовый баллон заполнен азотом, то масса его содержимого составляет 11% от общей. Какую часть от общей массы будет составлять масса газа, если тот же баллон заполнить аргоном при том же давлении и температуре? Считайте, что оба газа ведут себя как идеальные. Ответ выразите в процентах, округлите до целых.
→ Узнать ответ
7. Установите соответствие между физическими величинами и их единицами измерения.
Энергия
Масса молекулы
Мощность
Давление
Заряд
Длина
Дальтоны
Ангстремы
Миллиампер-часы
Электронвольты
Миллиметры ртутного столба
Килокалории в час
→ Узнать ответ
8. Установите соответствие между названием элемента и тремя словами, которые можно найти в описаниях истории его открытия.
Галлий
Протактиний
Московий
Фосфор
Гелий
Франций
Кальций, свинец, магическое
Менделеев, ошибка, родина
Фаянс, Менделеев, предшественник
Распад, жидкий, хроматография
Казармы, золото, секрет
Уран, жёлтый, вулкан
→ Узнать ответ
9. Нестабильный изотоп X с массовым числом 214 и зарядовым числом 88 претерпевает последовательно два α ‑распада с выделением ядер гелия и два β+ распада с выделением позитрона.
Определите массовое число образовавшегося после распадов изотопа.
Запишите символ образовавшегося после распадов элемента.
Элемент X очень опасен тем, что при попадании внутрь организма замещает другой элемент. Какой?
Ba
Ca
K
C
Na
→ Узнать ответ
10. Выберите на картинке предмет, используемый для соединения двух резиновых трубок между собой:
Выберите на картинке предмет, используемый для конденсации паров вещества при простой перегонке:
11. Имеются две слабые кислоты, HX и HY, для которых известно, что pKa(HX)>pKa(HY)
Какая из кислот является более сильной?
HX
HY
Кислотные свойства одинаковы
Имеются водные растворы этих кислот: раствор 1 (HX, 0.1 М), раствор 2 (HY, 0.1 М), раствор 3 (HX, 0.1 М и HY, 0.1 М) и раствор 4 (HX, 0.05 М и HY, 0.05 М). Расположите эти водные растворы в порядке увеличения pH.
Раствор 1
Раствор 2
Раствор 3
Раствор 4
→ Узнать ответ
12. Для количественного определения содержания хлорид‑ и бромид‑ионов (X) в водных растворах можно использовать метод Мора титрование раствора галогенида раствором AgNO3 известной концентрации (индикатор капля раствора K2CrO4, при этом протекает реакция:Ag++X−→AgX↓
Аналитическим сигналом при титровании по Мору является образование красного осадка, явно контрастирующего с галогенидом серебра. Запишите формулу вещества, из которого состоит этот осадок.
Для анализа состава 1.00 г порошка неизвестного галогенида щелочного металла было растворёно в 100 мл дистиллированной воды. При параллельном титровании 4 аликвот по 10 мл полученного раствора на титрование ушло 23.5, 23.6, 23.4, 23.5 мл 0.1 М раствора AgNO3. Запишите формулу проанализированного галогенида.
→ Узнать ответ
Задания 11 класс
1. Природный углерод содержит два устойчивых изотопа 12C и 13C. Природный хлор также содержит два устойчивых изотопа 35Cl и 37Cl. Сколько изотопомеров (молекул, отличающихся изотопным составом) можно составить для четырёхлористого углерода CCl4, используя только природные устойчивые изотопы углерода и хлора?
→ Узнать ответ
2. Тёмно-коричневый порошок, являющийся оксидом элемента X, сплавили с гидроксидом калия и нитратом калия. Полученный сплав растворили в воде и обработали избытком хлора. При этом получилось яркоокрашенное соединение A, обладающее антисептическими свойствами. При нагревании соединение A разлагается, а среди продуктов разложения присутствуют оксид элемента X и кислород. Определите элемент X. В ответ запишите его порядковый номер.
→ Узнать ответ
3. Жёлтое кристаллическое вещество Y нерастворимо в воде, но растворимо в 10%‑й азотной кислоте. Выберите вещества, подходящие на роль Y:
AgINa2CrO4
Ag3PO4
AgCl
CdS
FeS
BaCO3
→ Узнать ответ
4. При окислении 50 г насыщенного первичного одноатомного спирта получили 34.2 г альдегида. Выход составил 70% от теоретического. Определите молярную массу исходного спирта. Ответ выразите в г/моль, округлите до целых.
→ Узнать ответ
5. При поликонденсации терефталевой кислоты C6H4(COOH)2 и этиленгликоля HOCH2CH2OH образующийся полимер содержит, помимо полиэтилентерефталата, некоторое количество полиэтиленгликолевых звеньев. Для поликонденсации взяли 16.6 г терефталевой кислоты и 9.3 г этиленгликоля. Определите массовую долю полиэтиленгликолевых звеньев OCH2CH2 в полученном полимере, если известно, что непрореагировавших мономеров в реакционной смеси не осталось, а концевые группы в полимере можно не учитывать. Ответ выразите в процентах, округлите до целых
→ Узнать ответ
6. Выберите вещества, в структуре которых присутствуют гомоядерные ковалентные связи (т.е. связи между атомами одного и того же элемента):
Hg2Cl2
N2O5
BaO2
NH4NO3
N2O
C (графит)
HCOONa
TiO2.
→ Узнать ответ
7. Расположите следующие кислоты в порядке увеличения их силы.
Бензойная кислота
4‑Хлорбензойная кислота
4‑Метоксибензойная кислота
4‑Метилбензойная кислота
3‑Хлорбензойная кислота
4‑Нитробензойная кислота
→ Узнать ответ
8. Этанол окисляют подкисленным раствором дихромата калия. Установите соответствие между веществом и графиком зависимости его концентрации в реакционной смеси от времени.
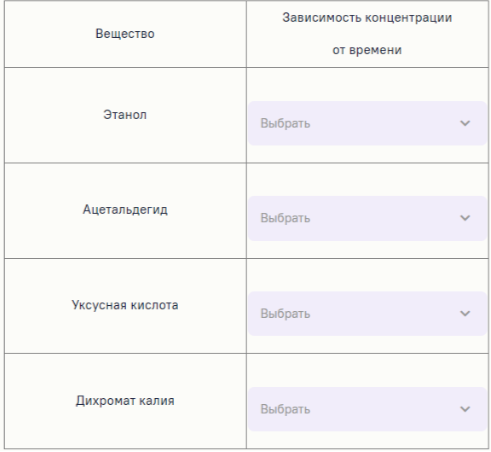
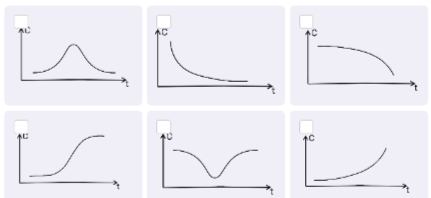
9. Энергия связи C-H в метане составляет 438.4 кДж/моль, связи H-Cl 431.6 кДж/моль, связи Cl-Cl 242.6 кДж/моль. Определите энергию связи C-Cl в хлорметане, если известно, что при хлорировании 1 моль метана до хлорметана выделяется 56.5 кДж теплоты. Ответ выразите в кДж/моль, округлите до десятых.
→ Узнать ответ
10. Установите соответствие между веществом и способом его промышленного получения.
Уксусная кислота
Формальдегид
Метан
Ацетилен
Окисление ацетона
Очистка природного газа
Окисление метанола
Гидролиз карбида кальция
Гидролиз карбида алюминия
Карбонилирование метанола
→ Узнать ответ
11. Лизин является незаменимой аминокислотой. Он содержится во многих продуктах питания. Дана таблица с ценами на продукты и содержанием лизина в них:
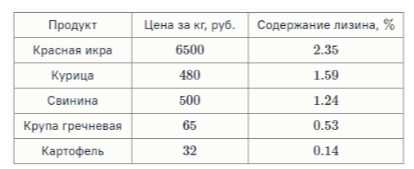
Расположите приведённые в таблице продукты в порядке увеличения стоимости в расчёте на 11 г лизина.
Красная икра
Курица
Свинина
Крупа гречневая
Картофель
→ Узнать ответ
12. Установите соответствие между химическим элементом и количеством неспаренных электронов в его атоме в основном состоянии.
Установите соответствие между химическим элементом и количеством неспаренных электронов в его атоме в основном состоянии.
Fe
Cu
Ca
Si
Se
P
Cr
Zn
0
1
2
3
4
5
6
7
→ Узнать ответ