
Официальный образец варианта заданий с ответами и решениями ВПР 2025 по Химии 10 класс с официального ресурса ФИОКО (Федеральный институт оценки качества образования). Демоверсия предназначена для подготовки учащихся к всероссийской проверочной работе (ВПР), которая пройдет в период с 11 апреля по 16 мая 2025 года.
→ Типовые (тренировочные варианты) по Химии 10 класс
→ Образец проверочной работы по Химии 10 класс
→ Описание проверочной работы по Химии 10 класс
Онлайн вариант ВПР 2025 по Химии 10 класс
Назначение всероссийской проверочной работы
Всероссийские проверочные работы (ВПР) проводятся в целях осуществления мониторинга уровня и качества подготовки обучающихся в соответствии с требованиями федеральных государственных образовательных стандартов и федеральных основных общеобразовательных программ. Назначение ВПР по учебному предмету «Химия» — оценить качество общеобразовательной подготовки обучающихся 10 классов в соответствии с требованиями федерального государственного образовательного стандарта основного общего образования (ФГОС ООО) и федеральной образовательной программы основного общего образования (ФОП ООО).
Структура проверочной работы
Проверочная работа состоит из двух частей и включает в себя 16 заданий различных типов и уровней сложности. Задания также имеют различия по требуемой форме записи ответа, который может быть представлен в виде последовательности цифр или символов, слова, формулы вещества, уравнения реакции. В части 1 содержатся задания 1–8; в части 2 – задания 9–16. В ответах на задания требуется записать молекулярную или структурную химическую формулу, уравнение реакции, ввести текст или дать подробное текстовое описание. В работе содержится 11 заданий базового уровня, в которых ответы на разные вопросы задания не зависят друг от друга. Их порядковые номера: 1, 2, 5–7, 9–10, 12–14, 16. В работе содержится 5 заданий базового уровня, в которых части задания взаимосвязаны и ответ на один вопрос зависит от ответов на предыдущие вопросы. Их порядковые номера: 3, 4, 8, 11, 15.
Инструкция по выполнению работы
На выполнение заданий части 1 проверочной работы по химии отводится один урок (не более 45 минут). Часть 1 включает в себя 8 заданий. Ответы на задания запишите в поля ответов в тексте работы. В случае записи неверного ответа зачеркните его и запишите рядом новый. При выполнении работы не разрешается пользоваться учебниками, рабочими тетрадями, справочниками. При выполнении работы разрешается использовать следующие дополнительные материалы: – Периодическая система химических элементов Д.И. Менделеева; – таблица растворимости солей, кислот и оснований в воде; – электрохимический ряд напряжений металлов; – непрограммируемый калькулятор. При необходимости можно пользоваться черновиком. Записи в черновике проверяться и оцениваться не будут. Советуем выполнять задания в том порядке, в котором они даны. В целях экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения работы у Вас останется время, то Вы сможете вернуться к пропущенным заданиям.
Задания проверочной работы по Химии
Задание 1. 2,2-диметилбутан – ценный углеводород. Его применяют для увеличения октанового числа автомобильного и авиационного топлива и в качестве растворителя.
а) Составьте молекулярную формулу этого вещества.
б) Составьте структурную формулу этого вещества.
Задание 1. Один из углеводородов, образующихся при каталитическом крекинге нефти, имеет структурную формулу:
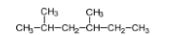
а) Составьте молекулярную формулу этого вещества.
б) Составьте название этого вещества по систематической номенклатуре.
Для выполнения заданий 2–4 используйте вещества, структурные формулы которых приведены ниже:
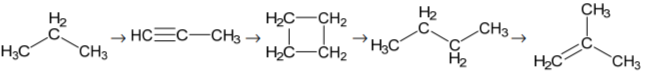
Задание 2. а) Из приведённых веществ выберите два вещества, которые являются изомерами.
б) Из приведённых веществ выберите два вещества, которые являются гомологами.
Запишите в таблицу структурные формулы соответствующих веществ.
Задание 3. Выберите из приведённых веществ предельный углеводород с наибольшей молярной массой и запишите структурную формулу продукта его взаимодействия с бромом на свету.
1) Предельный углеводород с наибольшей молярной массой:
2) Продукт реакции с бромом на свету:
Задание 4. Выберите из приведённых веществ непредельный углеводород с наибольшей молярной массой и запишите структурную формулу продукта его взаимодействия с водой.
1) Непредельный углеводород с наибольшей молярной массой:
2) Продукт реакции с водой:
Задание 5. При первичной переработке нефти исходное сырьё разделяют на фракции – смеси веществ, кипящих в определённом интервале температур. Основные фракции – бензин, керосин, попутный газ, газойль. Расположите их в порядке возрастания средней температуры кипения.
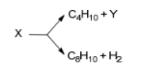
Задание 5. Ниже приведена схема (без коэффициентов) двух процессов, протекающих при химической переработке нефти, в которых участвует одно и то же исходное вещество. Установите молекулярные формулы веществ X и Y.
Задание 5. Ниже приведены формулы некоторых углеводородов, полученных при перегонке нефти. Укажите, какие из них входили в состав попутного газа, а какие – в состав бензиновой фракции. C2H6, C4H10, C6H14, C8H18.
Задание 6. Предложите реагенты и условия, с помощью которых можно осуществить следующие превращения: гексан → бензол → бромбензол.
Задание 6. Дана двухстадийная схема: Определите вещества X и Y, запишите их структурные формулы.
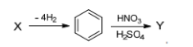
1) Структурная формула X:
2) Структурная формула Y:
Задание 7. В двух колбах находятся две жидкости: бензол и гексен-1. Укажите одно вещество, с помощью которого можно различить эти жидкости.
Задание 8. Сжигание автомобильного топлива – один из основных антропогенных источников углекислого газа в атмосфере. Экономичный автомобиль расходует 6 литров бензина (плотность – 750 г/л) на 100 км пробега. Примем, что формула бензина – C8H18 и он полностью сгорает с образованием углекислого газа. Определите, сколько литров углекислого газа (в пересчете на н.у.) выделится за 1 км пробега автомобиля. Для этого:
1) запишите уравнение реакции горения бензина;
2) рассчитайте массу бензина, который сгорит за 1 км пробега;
3) рассчитайте объём выделившегося углекислого газа (н.у.)
Инструкция по выполнению заданий части 2 проверочной работы
На выполнение заданий части 2 проверочной работы по химии отводится один урок (не более 45 минут). Часть 2 включает в себя 8 заданий. Ответы на задания запишите в поля ответов в тексте работы. В случае записи неверного ответа зачеркните его и запишите рядом новый. При выполнении работы не разрешается пользоваться учебниками, рабочими тетрадями, справочниками. При выполнении работы разрешается использовать следующие дополнительные материалы: – Периодическая система химических элементов Д.И. Менделеева; – таблица растворимости солей, кислот и оснований в воде; – электрохимический ряд напряжений металлов; – непрограммируемый калькулятор. При необходимости можно пользоваться черновиком. Записи в черновике проверяться и оцениваться не будут. Советуем выполнять задания в том порядке, в котором они даны. В целях экономии времени пропускайте задание, которое не удаётся выполнить сразу, и переходите к следующему. Если после выполнения работы у Вас останется время, то Вы сможете вернуться к пропущенным заданиям.
Задание 9. Одним из методов познания в химии является моделирование. Для описания веществ молекулярного строения используют шаростержневые модели, в которых атомы различных элементов изображают шарами разных цветов и размеров, а соединяющие их химические связи – палочками. На рис. 1 и 2 приведены шаростержневые модели молекул двух веществ.
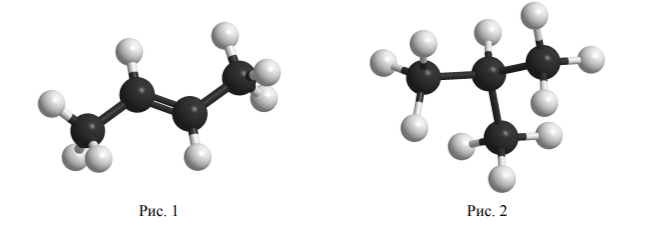
Каким веществам из приведённого ниже перечня соответствуют эти модели? Запишите в таблицу названия этих веществ. Перечень: пропан, бутан, бутен-1, бутен-2, 2-метилпропан, циклопропан.
Задание 10. Этиловый спирт – один из важнейших продуктов химической промышленности. Основное сырьё для его получения – этилен. Сколько граммов этанола можно получить из 560 л (н.у.) этилена, если выход продукта реакции составляет 80 %?
Задание 11. Метилбутират, или метиловый эфир масляной (бутановой кислоты), – жидкое вещество, обладающее яблочным запахом. Составьте структурные формулы этого вещества и продуктов его взаимодействия с раствором гидроксида калия.
1) Структурная формула метилбутирата:
2) Структурные формулы продуктов реакции:
Задание 12. В трёх колбах находятся три водных раствора: ацетона, муравьиной кислоты и метиламина. Укажите характер среды каждого из растворов. Заполните таблицу.
Кислотная среда, Нейтральная среда, Щелочная среда
Для выполнения заданий 13–15 используйте вещества, структурные формулы которых приведены в перечне:
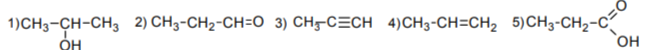
Задание 13. Из приведённого перечня выберите вещества, которые соответствуют указанным в таблице классам/группам органических соединений. Запишите в таблицу структурные формулы соответствующих веществ.
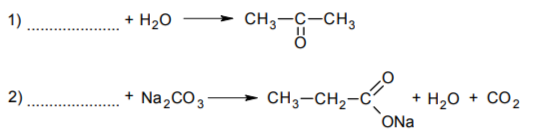
Задание 14. В предложенные схемы химических реакций впишите структурные формулы пропущенных веществ, выбрав их из приведённого выше перечня. Расставьте коэффициенты в полученных схемах, чтобы получились уравнения химических реакций.
Задание 15. Пропанол-1 применяют в качестве растворителя для восков, чернил, природных и синтетических смол, а также для синтеза пропионовой кислоты, пестицидов, некоторых фармацевтических препаратов. Пропанол-1 в промышленности получают из этилена по приведённой схеме превращений:
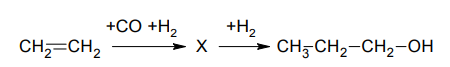
1) Впишите в заданную схему превращений структурную формулу вещества Х, выбрав его из предложенного выше перечня.
2) Запишите название вещества Х.
3) Дайте характеристику второй реакции (присоединения, замещения, отщепления, каталитическая, некаталитическая).
Задание 16. Современный легковой автомобиль содержит более 200 кг пластмасс. Так, обивку для сидений изготавливают из широко распространённого полимера X, который получают полимеризацией углеводорода Y. Установите молекулярную формулу Y, если при полном сгорании 22,4 л этого вещества образуется 67,2 л углекислого газа и 54 г воды (при н.у.). Назовите полимер X.